-
医药行业之君实生物研究报告:新冠小分子领先,PD~1冲刺美国上市
老范说评 / 2022-03-15 10:44 发布
国产 PD-1 的首个突破者,持续创新,国际化推进中
八年飞速成长,PD-1 于中国、新冠药物于美国,皆为国产首家获批
君实生物,是国内生物创新药头部企业,公司具备从药物发现到商业化的 全产业链能力,通过源头创新寻求 first-in-class 或者 best-in-class 的药物。 公司于 2012 年创立,2015 年新三板挂牌;2016 年完成对上海众合医药的 并购,共同开发单抗;2018 年香港上市,2020 年科创板上市申请通过。
自 2018 年 12 月,特瑞普利单抗,成为中国首个获批上市的的国产 PD-1 单抗以来,公司又斩获诸多国内与美国首个获批临床或上市。 2019 年 4 月与 2020 年 1 月,BTLA 单抗分别在美中获批临床, 为全球首个进入临床的、继 PD-1 之后的潜在重磅新免疫检测点 抑制。 2021 年 2 月,公司与礼来合作的埃特司韦单抗,是首个获美国食 药监局(FDA)紧急使用授权(EUA)的中国原研的新冠中和抗 体。 2021 年 12 月,VV116,成为乌兹别克斯坦首个批准紧急使用授 权的新冠小分子口服药;目前已完成国内 I期临床,正处于全球 多中心 II/III期临床中,大概率年内完成并提交上市申请。
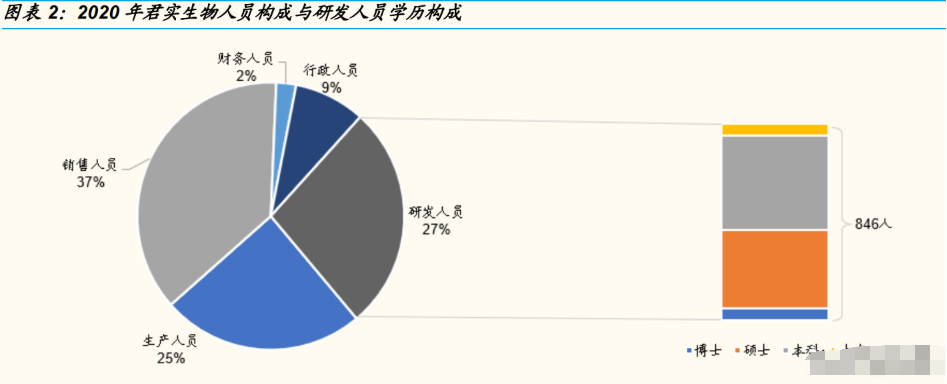
公司研发团队成员,皆拥有国际药企多年研发经验。公司现已构建较为完 善的创新药物发现、全球范围内的临床研究和开发、大规模生产以及商业 化的人才团队。截至 2021 年上半年,公司拥有研发人员 846 名,近半数 研发人员具有硕士以上学历;全球总员工超过 2500 人。
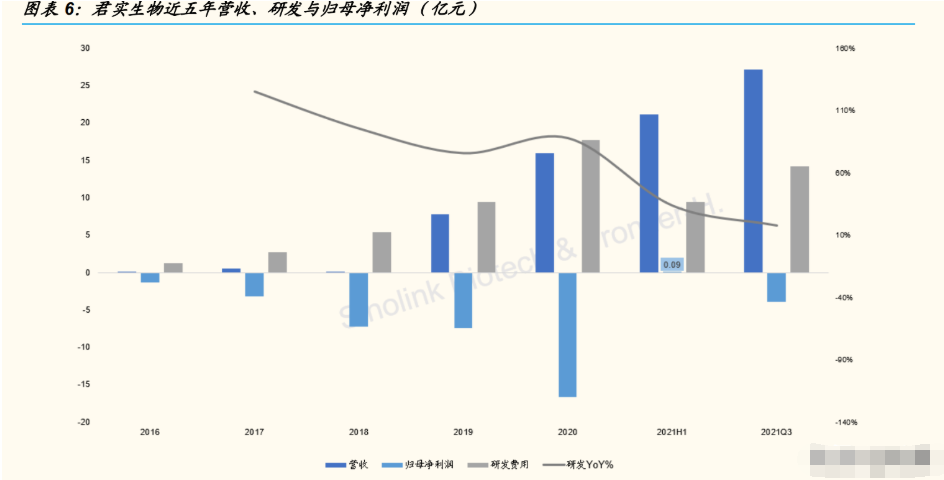
公司研发投入持续,内外部开发双管齐下。从 2016 年开始,公司的研发 投入一直保持高速增长的状态。2020 年研发投入达到 17.78 亿元,同比增 长 87.95%;2021 年研发投入近 21 亿元。研发费用主要用于内部自研的 投入增加以及通过与外部公司合作开发、权益引进的方式,拓宽创新管线。
公司在研的多条管线研发进度居世界前列。2015 年特瑞普利单抗获得 NMPA 的 IND 批准,成为第一个由中国公司研发的获得 IND 批准的抗 PD-1 单抗。2018 年,特瑞普利单抗在中国获批上市,成为国内首个 获得国家药监局批准上市的国产抗 PD-1 单抗,用于治疗既往标准治 疗失败后的局部进展或转移性黑色素瘤。2020 年,特瑞普利单抗治疗 复发性/转移性鼻咽癌 NDA 申请获 NMPA 受理;抗 BTLA 单抗(全球 首创)获得美国 FDA 的 IND 批准;应对疫情,埃特司韦单抗研发进展 迅速,成为首个在美国被批准使用的中国研发创新药物。
突破 Breakeven,在研管线丰富,商业化后劲可期
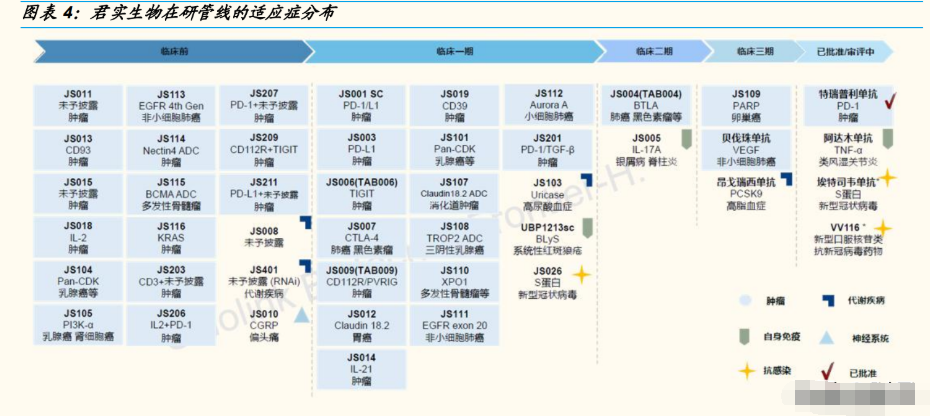
公司产品覆盖肿瘤免疫治疗、代谢类疾病、抗感染、自身免疫和神经系统 5 大热门治疗领域。目前,公司产品中有 3 个处于商业化阶段(特瑞普利 单抗、埃特司韦单抗和 VV116)、1 款产品处于上市申请阶段。
公司营收的快速增长得益于特瑞普利单抗、埃特司韦单抗的销售收入。公 司在 2021 年上半年首次突破盈亏平衡,实现归母净利润 900 万元。根据 最新业绩预告,公司 2021 年总营收过 40 亿元;我们估计收入构成 3 部分, 特瑞普利单抗销售收入,Coherus 合作的首付款项 1.5 亿美元,与礼来合 作的新冠中和抗体的销售分成与里程碑收入近 2 亿美元。
引进补充自研产品管线,携手 Coherus 推进美国商业化进程
公司积极寻求国内外优秀的生物科技公司,通过获取权益、股权投资的方 式拓展产品管线,加大在药物联合治疗领域的布局,构建起以特瑞普利单 抗为中心,多层次用药的产品梯队。公司的合作范围涉及单抗、小分子药、 ADC 药物等。
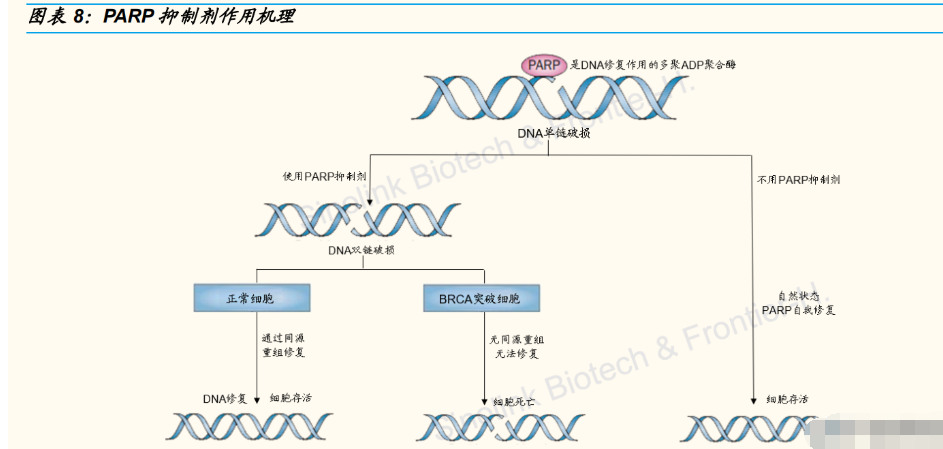
与英派药业共同设立公司,取得 PARP 抑制剂 50%权益。2020 年 8 月,公司与英派成立君派英实药业有限公司,英派向合资公司转让 IMP4297(JS109)相关所有权。IMP4297 是一种靶向聚-ADP 核糖聚 合酶(PARP)的小分子抑制剂,利用出现 BRCA1/2 基因突变的肿瘤 细胞具有同源重组修复缺陷的特点,特异性杀死细胞。IMP4297 正在 进行具有 BRCA 突变的晚期卵巢癌患者的临床三期研究。
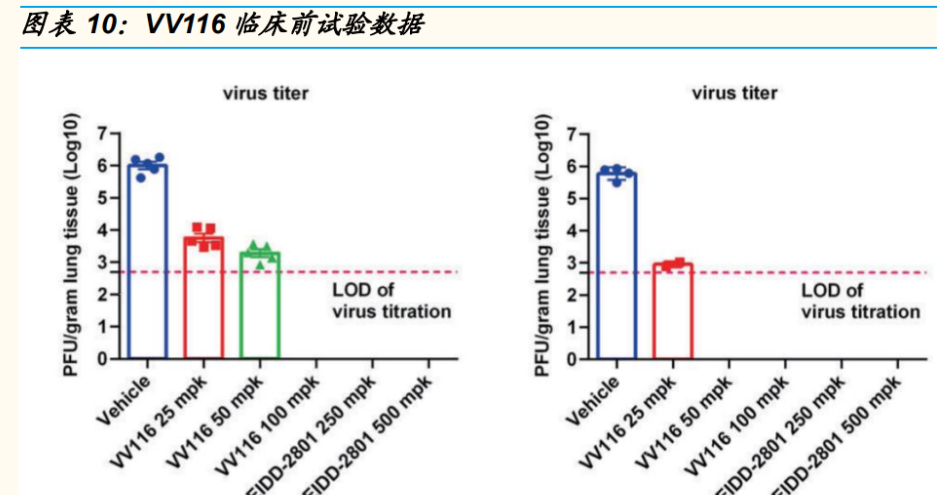
公司与旺山旺水公司合作,开发口服核苷类新冠药物 VV116 以及 3CL 蛋白抑制剂口服新冠药 VV993。2021 年 10 月,公司与旺山旺水公司达成合作,共同承担口服 新冠候选药物 VV116 的临床和商业化工作。VV116 是一个三异丁酸酯 前药的氢溴酸盐形式,口服后可以迅速代谢为 VV116 核苷。临床前数 据显示,VV116 出现显著的抗新冠病毒作用,在小鼠模型中,VV116 和 Molnupiravir 都显示出了将肺部病毒滴度降低至检测线以下的能力。 12 月 30 日,VV166 在乌兹别克斯坦取得 EUA,成为继 Molnupiravir、 Paxlovid 之后全球第三款获批的口服新冠药物。2022 年 1 月,君实宣 布与旺山旺水公司共同开发 3CL 蛋白酶的口服新冠药,临床前研究表 明可以降低病毒复制,显著改善肺部感染,且具有较好的安全性。
携手 Coherus,助力特瑞普利单抗实现国际化。2021 年 2 月,公司与 Coherus 签署商业化合作协议,授予 Coherus 在美国和加拿大关于特瑞普 利单抗的独家许可以及两个可选项目(JS006 和 JS018)的优先谈判权。 此次交易 Coherus 将支付公司 1.5 亿美元的首付款以及不超过 3.8 亿美元 的里程碑款项。我们认为,此次合作有助于公司开拓海外商业化网络,为 之后产品在国际市场的销售奠定基础。
特瑞普利单抗 NSCLC 上市申请获受理,大适应症格局扭转在即
PD-1 市场角逐激烈,特瑞普利单抗国产首个获批者
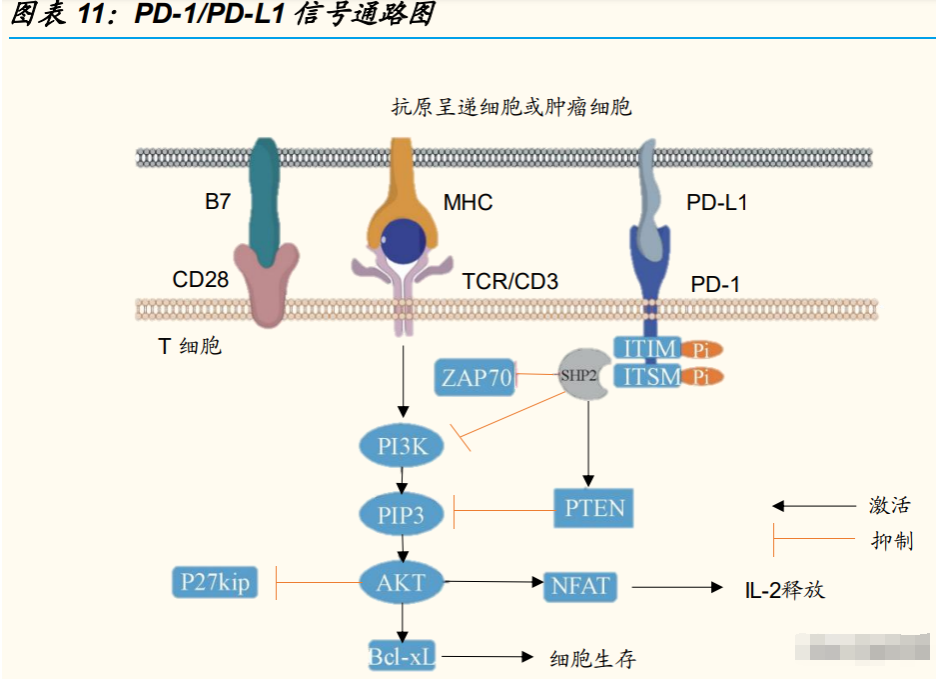
PD-1/L1 是肿瘤过度激活细胞通路发生免疫逃逸中的一个激活位点。程序 性死亡受体-1(PD-1)与程序性死亡配体(PD-L1)结合会抑制 T 淋巴细 胞发挥免疫应答。PD-L1 会在多种肿瘤表面高表达,例如黑色素瘤、卵巢 癌、尿路上皮癌、肺癌等。高表达的 PD-L1 与 T 淋巴细胞 PD-1 结合,引 发免疫受体酪氨酸抑制基序(ITIM)和免疫受体酪氨酸转换基序(ITSM) 磷酸化,进而招募磷酸化酶抑制 T 细胞抗原受体(TCR)信号通路上多个 蛋白去磷酸化,抑制 T 细胞的产生,引发免疫逃逸机制。
研究表明,单独阻断 PD-1 或者 PD-L1 可以增加肿瘤部位的 T 细胞以及 γ 干扰素的数量,通过恢复 T 细胞的免疫能力来抑制肿瘤的生长。由于针对 PD-1/PD-L1 通路而开发的生物抑制剂适用于多种癌症的治疗,成为了创新 药企研发的热门靶点。
2014 年,来自默沙东的 Keytruda(通用名:帕傅利珠单抗;简称:K 药) 被 FDA 批准用于治疗晚期黑色素瘤,拉开了美国针对 PD-1 靶点进行肿瘤免疫治疗的序幕。截至 2021 年 7 月,FDA 已批准 7 款 PD-1/PD-L1 产品; NMPA 已获批 10 款产品,其中国产 PD-1 占据 6 席。
K 药积极探索在其他实体瘤领域的治疗潜力。2015 年,一项使用 K 药治疗 41 名晚期肿瘤的研究把患者分成具有错配修复缺陷(mismatch repair deficient, dMMR)的肠癌患者,具有错配修复缺陷的其他肿瘤患者以及错 配修复正常(mismatch repair proficient, pMMR)的肠癌患者。结果显示, 具有 dMMR 的肠癌组和 dMMR 其他肿瘤组要比 pMMR 肠癌组具有更好的 ORR(客观缓解率)和 DCR(疾病控制率)。2017 年,FDA 批准 K 药用 于治疗微卫星高度不稳定性/dMMR 的实体瘤,是历史上第一次以分子事件 给药而非根据肿瘤类型进行给药,具有十分重大的里程碑意义。
微卫星不稳定性(MSI)指的是由于 DNA 甲基化或者基因突变导致 MMR 功能出现异常,会导致微卫星重复序列的核酸数量异常的现象。 研究表明,检测 MMR 的状态可以预测 PD-1/L1 抑制剂的治疗效果。 对于 MSI-H/dMME 的患者应用 PD-1 免疫疗法显示出更好的治疗效果。
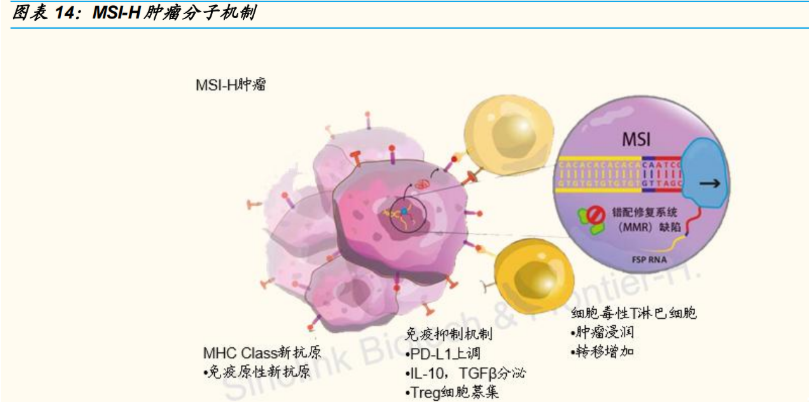
K 药被批准成为首个按照生物标志物进行区分的抗肿瘤药物,主要基 于 5 项临床试验。149 名来自 15 种不同癌种但均属于 MSI-H/dMMR 的患者的临床试验表明,患者总体的 ORR(客观缓解率)为 39.6%, CR(完全缓解率)为 7%,78%的患者缓解持续时间超过 6 个月。
对标国内,公司产品拓益(通用名:特瑞普利单抗)是中国首个研发并上 市的抗 PD-1 单抗,于 2018 年 12 月获批,进度领先于其他国产 PD-1 研 究,具有一定的先发优势。公司拥有不少于 20 项关于特瑞普利单抗的临床 试验,其中关于黑色素瘤二线治疗、鼻咽癌一线、三线治疗、尿路上皮癌 二线治疗已经获得 NMPA 批准,非小细胞肺癌的一线治疗上市申请已经获 NMPA 受理。
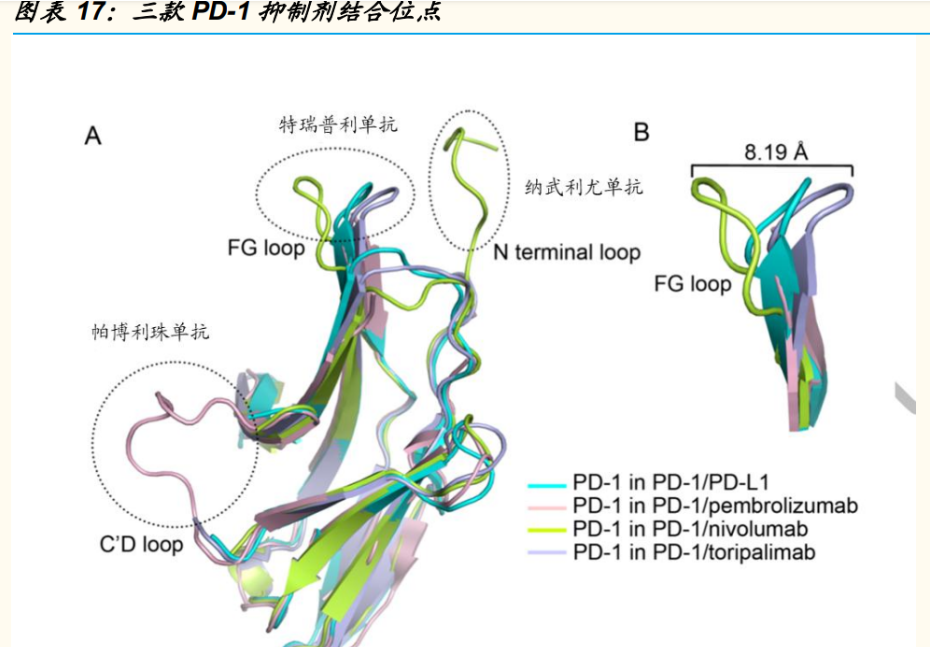
特瑞普利单抗是一款 IgG4/Kappa 亚型的国产原研免疫检查点抑制剂,具 有全新的 CDR 序列,与 K 药主要结合 PD-1 抗原 C’端的 D 环、O 药主要 结合 N端环不同,特瑞普利单抗主要结合 PD-1 抗原的 FG 环。此外,特 瑞普利单抗具有独特的诱导 PD-1 内吞的作用,使得特瑞普利单抗不仅能 阻断 PD-1 和配体结合,并能降低 PD-1 膜表面表达。(报告来源:未来智库)
PD-1 市场玩家多,进入医保,以价换量或提升市场份额
中国 PD -1/PD-L1 市场增速超全球,目前处于发展的黄金阶段。根据公司 招股书,2020 年全球 PD-1/PD-L1 单抗市场规模为 306 亿美元,2020- 2025 年间 CAGR 达 17%;2020 年中国 PD-1/PD-L1 单抗市场规模为 20 亿元,预计 2025 年这一数字可达 75 亿美元,2020-2025 年间 CAGR 达 30.5%。尽管中国的 PD-1 研究晚于全球,但目前登记在册的关于 PD-1 的 临床试验记录多达 60 条,有 12 款处于批准上市+上市申请阶段。我们认 为,如此多的临床试验印证了 PD-1 在肿瘤应用领域的广阔前景,随着越 来越多的国产 PD-1 获批,中国的 PD-1 竞争格局愈发激烈。
纵观全球 PD-1/L1 类产品的销售情况,2014 年是默沙东和 BMS 两家独大 的局面,而如今获批的厂家越来越多。随着获批适应症数量、生产公司数 量的增加,全球 PD-1/PD-L1 抗体产品销量飞速增长,2014 年至 2020 年, 全球销售收入从 0.61 亿美元增长至 275.73 亿美元。与此同时,也应该看 到最先获批的 K 药与 BMS 的 O 药(纳武利尤单抗)仍然占据了绝大部分 的市场份额,2020 年 K 药销售额占比 52%,O 药销售额占比 25%。国产 PD-1 产品的销售额占比在全球仅为个位数。
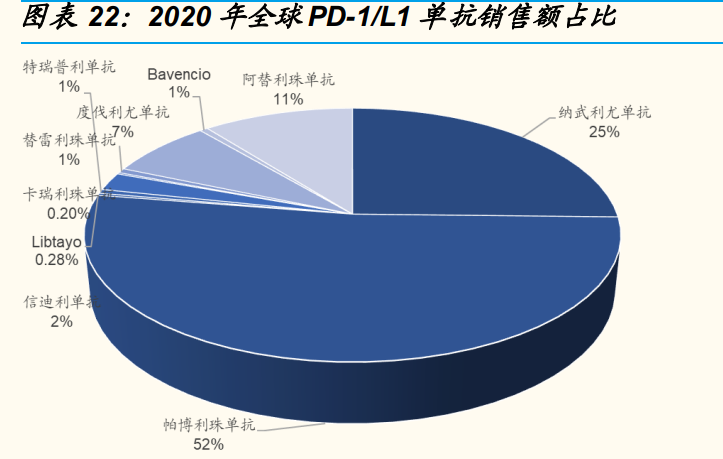
自 2018 年 K 药和 O 药进入中国市场,加之国产 PD-1 获批,中国的 PD1/L1 单抗的销售规模增速迅猛,且参与厂商越来越多。仅考虑 PD-1 的销 售收入,2020 年中国 6 家获批的 PD-1 药品销售额达 107.87 亿元,同比 增长 350%。2021 年 8 月,康方生物的派安利普单抗以及誉衡生物的赛帕 利单抗取得上市批准。至此,我国形成了“2 款进口+6 款国产”的 PD-1 销售 格局。
国产 PD-1 单抗纳入医保,价格优势明显,压缩进口 PD-1 单抗在中国的市 场份额。2020 年,4 款批准上市的国产 PD-1 单抗均纳入医保目录,于 2021 年 3 月开始生效,大幅减轻了患者的用药负担。对比 2019 年和 2021 上半年中国 PD-1 单抗销售份额,可以看出 K 药和 O 药的销售份额有较为 明显的下降趋势,2019 年进口 PD-1 单抗销售份额占比 53%,2021 年该 占比下降至 31%。此外,信达、恒瑞的 PD-1 单抗获批适应症中包括大癌 种非小细胞肺癌,在销售份额增长上体现较为明显。相较而言,由于公司 目前获批适应症为小适应症黑色素瘤,在市场份额的比较上,有所下降。
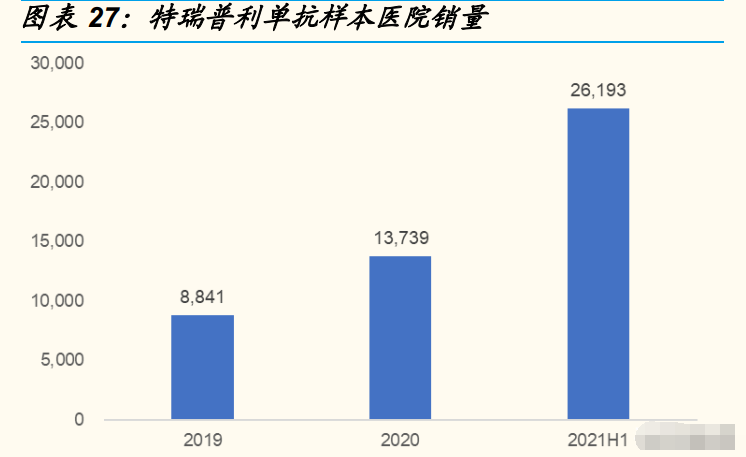
进入医保,以价换量。2021 年医保谈判,特瑞普利单抗用于鼻咽癌、尿路 上皮癌的治疗谈判成功,特瑞普利单抗纳入医保的适应症数量增加至 3 种。 从销量来看,2021 年上半年特瑞普利单抗的销量已经接近 2020 年全年销 量的两倍。我们认为,医保降价、医保覆盖适应症增多对于产品销量的提 升具有积极的促进作用,尤其是在黑色素瘤治疗上,目前国产 PD-1 产品 中尚未有此适应症的获批。
“一线+围手术期”适应症范围日益扩大,肺癌大适应症即将获批
对比进口与国产 PD-1/PD-L1 的获批适应症范围,可以看出国产 PD-1 产品 获批适应症数量总体少于进口 PD-1/PD-L1 产品。海外 PD-1/L1 产品获批 适应症种类较多,涉及到 22 种癌症类型,国产 PD-1 产品仅涉及 8 种癌症 类型。国产 PD-1 单抗多选择从小适应症入手,例如霍奇金淋巴瘤、鼻咽 癌、黑色素瘤;再往大适应症延伸,例如信达、恒瑞、百济神州已经获批 非小细胞肺癌适应症。
特瑞普利单抗是国产 PD-1 单抗中唯一被批准用于治疗晚期黑色素瘤的药 物。与 K 药相比,特瑞普利单抗具有一定竞争优势。从临床数据来看,在 亚洲患者常见的肢端型黑色素瘤中,两种药物的反应率差距较小。但特瑞 普利单抗在 PD-L1+患者中表现更好。
向前线治疗方案进军,鼻咽癌联合化疗一线治疗已获批,食管鳞癌一线治 疗递交 NDA。与后线治疗相比,一线治疗往往具有更长的用药时间,有助 于提高药品的销量。我们认为,随着公司二线布局的完善以及一线适应症 上市申请稳步推进,预计特瑞普利单抗的适应症获批将进入爆发期。
特瑞普利单抗联合化疗用于一线治疗鼻咽癌的研究成果以封面形式发表在 《自然-医学》杂志,这是首个证明比起单纯化疗,联合治疗可以获得更好 的 PFS(无进展生存期)和 OS(中位总生存)的国际三期临床试验。联 合疗法的 ORR(客观缓解率)为 77.4%,单独化疗的 ORR 为 66.4%。

公司已向 FDA 滚动提交了用于治疗复发或转移性鼻咽癌的 BLA,目前 已经受理,FDA 给予优先审评认定,拟定的处方药用户付费法案 (PDUFA)目标审评日期为 2022 年 4 月。未来公司将继续提交在食 管鳞癌、肺癌、三阴性乳腺癌等大癌种的在美上市申请。通过增加获 批适应症来加大产品的应用空间,进而提高市场份额。
特瑞普利单抗联合化疗用于一线晚期食管鳞癌临床数据显示,联合疗法组 OS 和安慰剂组中位 OS 分别为 17 个月和 11 个月;与安慰剂组相比, 联合疗法组 PFS 显著改善(HR=0.58 [95% CI:0.46-0.74], P<0.00001)。
前瞻布局“围手术期”治疗方案,潜在市场大。“围手术期”一般指从决定手术 开始到与手术相关治疗基本结束的一段时间。手术后接受的治疗称为辅助 治疗,而手术前接受的治疗称为新辅助治疗。研究表明,新辅助治疗在手 术前介入,可能存在更多特异性的 T 细胞,手术效果更好。
对肺癌患者,形成了涵盖新辅助治疗的、较为全面的用药布局,在研管线 中有 4 项针对肺癌进行研究。2021 年 12 月 10 日,特瑞普利单抗联合标准 一线化疗用于未经治疗、驱动基因阴性的晚期 NSCLC 的新适应症上市申 请获得受理,我们认为,若针对 NSCLC 的适应症成功获批,将是特瑞普 利单抗应用于大适应症的重要转变,未来放量可期。
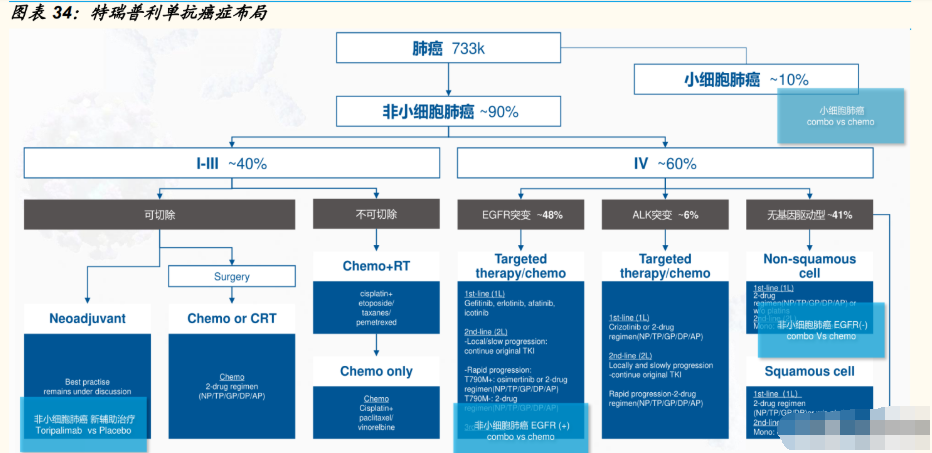
2020 年中国新发肺癌病例数 81.6 万,其中约 90%为非小细胞肺癌 (NSCLC)。其中,约 40%的 NSCLC 患者处 I-III期,可考虑手术切 除。Choice-01 是特瑞普利单抗联合化疗一线治疗晚期 NSCLC 的国际 多中心Ⅲ期注册性临床研究,在 2021 年世界肺癌大会上公布了实验结 果。临床结果显示,接受特瑞普利单抗+化疗组中位 PFS 为 8.3 个月 (安慰剂+化疗组中位 PFS 为 5.6 个月),可显著延长患者无进展生存 期。此外,该项试验的次要临床终点 OS 也观察到了获益趋势,截至 2021 年 3 月,接受特瑞普利单抗+化疗组中位 OS 为 21 个月,而对照 组为 16 个月。
中国创新药企接受的首个 ODAC 会议上,FDA 对国产创新药进入美国 提出了非常宝贵的指导意见,针对临床试验设计的道德伦理、终点选 择提出了更为严格的要求。Choice-01 允许对照组疾病进展后进行主动 交叉治疗,符合 WHO 关于科学伦理和道德规范,考虑到了患者的利 益;选择 PFS 为主要研究终点、OS 为次要研究终点(试验进行过程 中采集数据而并非实验完成后收集)有助于日后申报核查。我们认为, 上述两点有助于 Choice-01 日后在美国以非小细胞肺癌大适应症进行 申报。
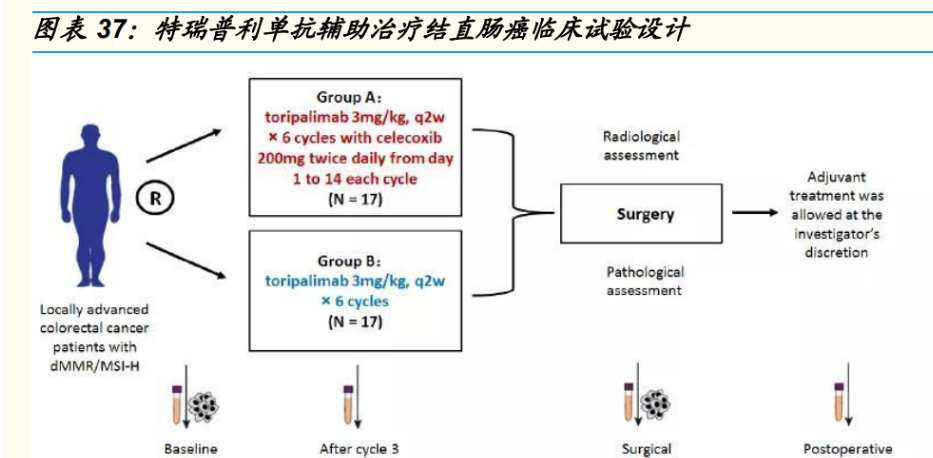
特瑞普利单抗辅助治疗 dMMR/MSI-H 的局部进展期结直肠癌临床试验 pCR(病理完全缓解率)高达 88%,结果于 2021 年 10 月在《柳叶刀》在线发表。在这项随机、单中心、平行、非对照的二期临床研究结果 显示,特瑞普利单抗单药新辅助治疗 pCR 为 65%,特瑞普利单抗联合 塞莱昔布(COX-2 抑制剂)新辅助治疗 pCR 为 88%,所有患者均存 活且无复发。
首个国产新冠中和抗体美国获批 EUA,新研发推进中
全球首个在健康受试者中开展临床试验的中和抗体,速度彰显研发实力
中和抗体项目进展迅速,创造多个“第一”。应对新冠疫情,公司与中国科学 院微生物研究所开展新冠中和抗体(埃特司韦单抗)项目,仅用 4 个月就 完成抗体的临床前开发工作,是全球首个在健康受试者中开展的新冠病毒 中和抗体临床试验,也是国内最早进入临床阶段的新冠病毒中和抗体。
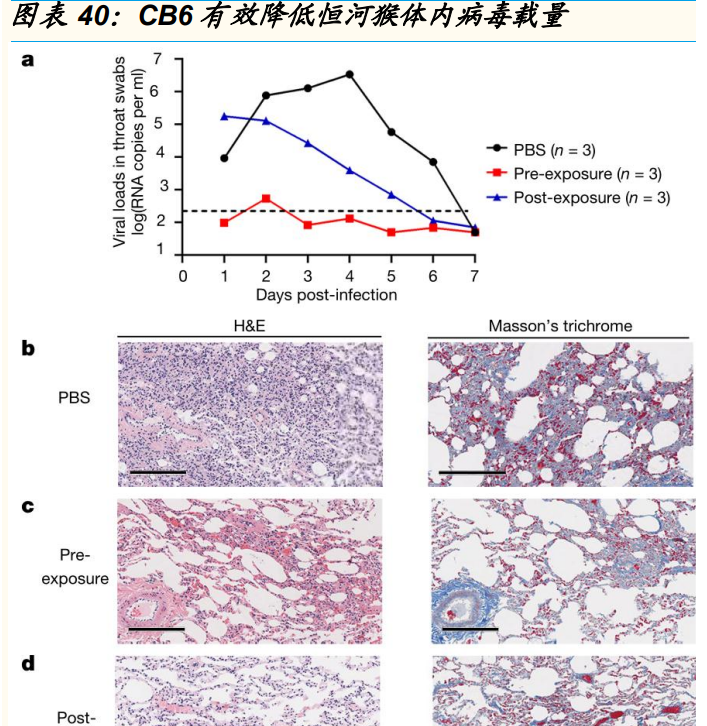
埃特司韦单抗是一款重组全人源中和抗体,通过特异性结合新冠病毒表面 刺突蛋白受体结合域,进而阻断病毒与宿主细胞的 ACE2 受体结合。中和 抗体的临床前研究结果获《Nature》杂志在线发表,体外试验结果显示 CA1 和 CB6 具有较强的中和活性;动物试验显示 CB6 可以显著抑制新冠 病毒对恒河猴的感染。
携手礼来开展新冠中和抗体“鸡尾酒”疗法,中国原研首个美国获批
与美国礼来签订《研发合作和许可协议》,共同研发及商业化埃特司韦单抗。 2020 年 5 月,公司牵手礼来,授予礼来在大中华地区之外对埃特司韦单抗 的独占许可。根据协议,礼来制药需要向公司支付 1000 万美元的首付款 以及不超过 2.45 亿美元的里程碑款项,以及后续产品销售金额两位数百分 比的销售分成。
除了与君实合作开发埃特司韦单抗之外,礼来在 2020 年 3 月与 AbCellera 合作,取得了巴尼韦单抗(LY-CoVer555)共同开发权。2021 年 7 月,关 于联合使用埃特司韦单抗和巴尼韦单抗的“鸡尾酒”疗法治理轻度至中度新冠 患者的三期试验达到主要研究终点,临床数据发表在《新英格兰医学杂志》。 这项随机、双盲、安慰剂对照的三期临床结果显示,联合疗法组出现住院 或者死亡的概率较低,且病毒载体下降的速度更快。
埃特司韦单抗和巴尼韦单抗联合疗法可降低 70%因新冠住院和死亡的风险。 实验数据表明,因为新冠病毒住院或者全因死亡的概率为 2.1%,对照 组中这一概率为 7%;联合疗法组无死亡病例,而安慰剂组中有 10 例 死亡。
2021 年 2 月,FDA 批准“鸡尾酒”疗法的紧急使用授权(EUA),用于轻度 或中度新冠患者;2021 年 12 月,FDA 批准了联合疗法的 EUA 范围扩大 至 0-12 岁高危儿科患者,是全球首个且唯一能在 12 岁以下人群中紧急使 用的中和抗体疗法。目前,联合抗体疗法已在全球超 15 个国家和地区获得 EUA。
截至 2021 年 3 月,全球有超过 40 家公司在进行新冠中和抗体研究,走在 前列的有君实/礼来、再生元、阿斯利康、GSK、腾盛博药。再生元中 和抗体联合疗法于 2020 年 11 月取得 EUA;GSK 的中和抗体于 2021 年 5 月取得 EUA;阿斯利康的中和抗体于 2021 年 8 月取得 EUA,用 于暴露前预防;腾盛博药中和抗体联合疗法已经递交 EUA 申请。
新冠中和抗体抢先机,美国政府订单过百万剂
受变异株影响,2021 年 6 月美国政府宣布暂停供应埃特司韦单抗/ 巴尼韦 单抗联合疗法,原因是君实/礼来联合疗法对于变异株 Gamma 和 Beta 的 中和能力有限,而当时这两个变异株在美国比例已超过 10%。权威期刊 《Cell》发表的一篇有关中和抗体对于变异株中和能力的实验结果表明, 君实/礼来双抗疗法对 Gamma 和 Beta 株的中和效果并不明显。
2021 年 8 月,FDA 决定重新给予君实/礼来联合疗法 EUA。当时,由变异 株 Delta 引起的新冠病例占比高达 96%,考虑到中和抗体对于 Delta 变异 具有良好的中和抗体,FDA 重新授予君实/礼来中和抗体 EUA。

2021 年 9 月,美国政府向礼来购买了 38.8 万剂埃特司韦单抗,价值 3.3 亿美元;2021 年 11 月,美国政府向礼来再度采购 61.4 万剂联合疗法用药, 价值 12.9 亿美元。根据协议,礼来需要在 2021 年 12 月 31 日前向美国政 府提供至少 40 万剂联合疗法用药。此次采购,再次证明了美国政府对联合 疗法在新冠治疗上的认可。
自有药物从发现到商业化完整产业链,in-house 研发实力不容小觑
三大研发中心分工合作,两大生产基地提供产能保障
全球一体化研发体系,覆盖药物发现到产业化全产业链。目前公司拥有三 个研发中心,分别位于旧金山、马里兰和苏州。他们彼此间分工合作,高 效协同,有助于公司降低研发成本。美国旧金山、马里兰研发中心主要进 行抗体筛选、靶点开发,苏州实验室承担后续的研发支持工作。 7 个核心技术平台构建起强大技术壁垒。公司拥有完整的全生命周期的药 物研发技术体系,包括人体膜受体蛋白组库和高通量筛选平台、抗体筛选 及功能测定的自动化高效筛选平台等。
苏州和上海两大生产基地,为产品商业化提供产能保障。江苏吴江的 生产基地拥有 4500L 发酵能力,其中新增的 1500L 用于阿达木单抗的 原研和其他在研药物的用药生产。上海临港生产基地项目于 2019 年底 投入生产,拥有 5 条生产线总计 30000L 产能储备。
以 BTLA单抗为代表的 FIC 管线夯实中,中美两地同时推进
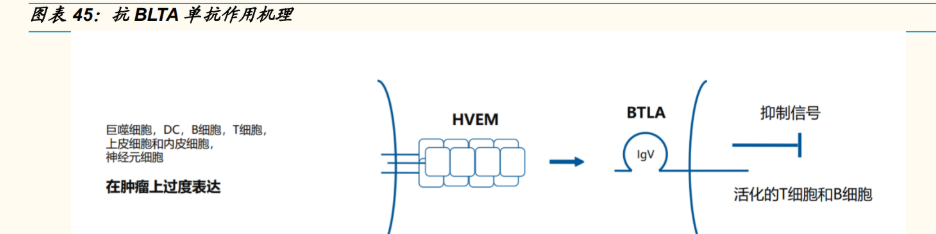
JS004 是全球首个(First-in-Class)特异性针对 B 细胞和 T 淋巴细胞衰减 因子(BTLA)的抗 BTLA 单抗注射液,目前尚无同靶点进入临床的公开披 露信息。抗 BLTA 单抗通过促进肿瘤特异性 T 淋巴细胞增殖和提高淋巴细 胞的功能来减轻肿瘤负荷。
抗 BTLA 单抗采用“中美双报”的模式来推进开发,于 2019 年 4 月和 2020 年 1 月分别获得 FDA 和 NMPA 的 IND 批准。目前已经完成 Ia 期剂量爬坡 研究,进入 Ib/II 期剂量扩展阶段。与此同时,公司也在开展抗 BTLA 单抗 和特瑞普利单抗联合用药临床试验,探索二者之间的协同作用。
阿达木单抗类似药进入获批制证阶段,原研进入医保有助于渗透率提升
UBP1211 为重组人源抗 TNF-α 单抗注射液,针对包括类风湿性关节炎在 内自身免疫性疾病,为修美乐(阿达木单抗)的。抗 TNF-α 单抗通过与 TNF-α 受体结合来抑制 TNF-α 与 TNF-α 受体结合,阻止炎症的发生。
临床前研究结果显示,阿达木单抗类似物 UBP1211 与修美乐在结构、功 能及药代动力学上有高度相似性。
国内抗 TNF-α 市场产品众多,且针对适应症多有重合,同类产品竞争加剧。 除原研修美乐之外,中国已有 5 款阿达木单抗获批,分别来自百奥泰、海 正药业、信达生物、复宏汉霖和正大天晴。公司于 2019 年 11 月提交上市 申请。我们认为,原研药进入医保有助于推动国内 TNF-α 抑制剂需求和销 量上涨,但同类型产品竞争较为激烈,公司阿达木单抗类似物 UBP1211 获批之后,预计会面临较大的销售压力。

昂戈瑞西单抗临床数据表现优异,或成高血脂患者福音
中国血脂异常患病率不断提高,临床需求提升。根据 MONICA 研究显示, 通过多次调查比较发现,20 世纪 80-90 年代中国总胆固醇水平呈上升趋势, 而发达国家的人群胆固醇水平呈现下降趋势。我们认为,随着中国血脂异 常疾病发病率的增加,以及未来疾病知晓率的治疗率可预期的提升, PCSK9 治疗的市场前景较好,将面临较大的临床需求。
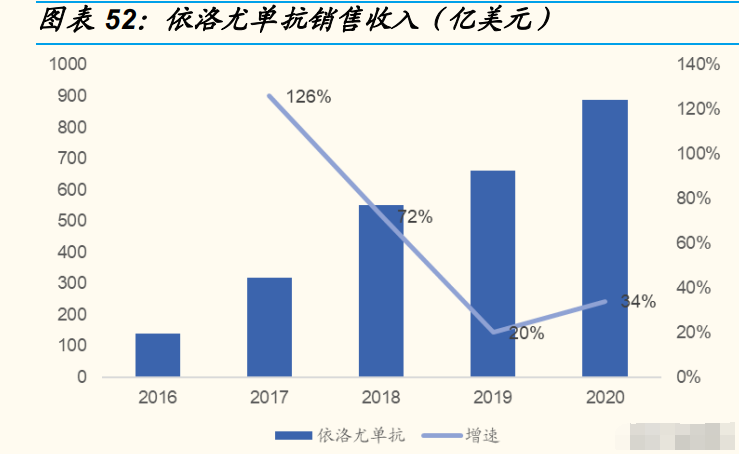
PCSK9(前蛋白转化酶枯草溶菌素 9)是他汀类药物之后公认的最有效的 降脂靶点 。目前全 球上市 的 2 个 PCSK9 单抗 药物, 依洛尤 单抗 (evolocumab,安进)和阿利西尤单抗(alirocumab,赛诺菲/再生元)在 降低 LDL-C 水平方面均表现出了惊人的效果,可显著降低对他汀类药物不 耐受的高胆固醇血症患者的 LDL-C 水平,并且具有良好的安全性。
PCSK9 降脂类药物销售收入增速呈现反弹趋势。2019 年,依洛尤单抗和 阿利西尤单抗销售收入增速都出现了下滑的趋势,原因是这两款药物的售 价较高。2020 年,安进宣布依洛尤单抗的价格从 14540 美元下调至 5850 美元,收入增速开始回弹。2021 年,阿利西尤单抗在中国申请主动降价。
目前没有国产 PCSK9 抑制剂获批上市,公司研发进度国内领先。根据医 药魔方数据统计,截至 2022 年 1 月,我国一共有 38 项登记在册的 PCSK9 抑制剂临床试验,分别来自于君实、信达、辉瑞、恒瑞等企业。我 们认为,PCSK9 抑制剂相较于其他降脂药物效果更好,限制销量的因素主 要是由价格导致,进口的两款 PCSK9 抑制剂药物已经开始进行降价策略, 随着日后国产 PCSK9 的获批,售价有进一步下降的可能,届时 PCSK9 市 场空间有望提升。
根据已获得的临床研究数据,PCSK9 抑制剂 JS002 显示出良好的安全性 及耐受性。研究过程中未报告任何严重不良事件。在降低 LDL-C 方面, JS002 显示出与同靶点产品可比的降脂幅度,以及更长的持续时间。关于 治疗高胆固醇血症的三期临床研究已经完成患者入组。(报告来源:未来智库)
盈利预测
目前公司商业化产品主要是特瑞普利单抗、埃特司韦单抗,新冠口服小分 子 VV116 已经获得乌兹别克斯坦 EUA,有望于 2022 年在中国获批。阿达 木单抗已经处于审批完成制证阶段;昂戈瑞西单抗 PCSK9、PARP 抑制剂 处于临床三期阶段,预计 2023 年获批。我们仅考虑特瑞普利单抗的销售 收入、埃特司韦单抗在海外的销售收入以及 VV116、阿达木单抗、昂戈瑞 西单抗和 PARP 抑制剂获批后带来的销售增量。
特瑞普利单抗:获批适应症 4 项,分别是黑色素瘤二线治疗、鼻咽癌 三线治疗、尿路上皮癌二线治疗以及鼻咽癌联合化疗的一线治疗。由 于联合化疗的鼻咽癌一线治疗于 2021 年 11 月获批,假设于 2022 年 开始贡献营收。此外,根据各条管线临床进度,我们假设国内食管鳞 癌的一线治疗于 2022 年获批;非小细胞肺癌一线治疗于 2023 年获批; 小细胞肺癌一线治疗、三阴乳腺癌于 2024 年获批;肝细胞癌一线治疗、 肾细胞癌一线治疗于 2025 年获批。根据 FDA 给出的 PRUFA 为 2022 年 4 月,假设特瑞普利单抗在美国 2022 年 4 月获批一线联合顺铂以及 二线单药治疗鼻咽癌。中国售价,根据 2021 年特瑞普利单抗医保价格, 假设 2021 年年度治疗费用 4.89 万元/人;根据新医保目录中特瑞普利 单抗出现降价,假设 2022 年之后年治疗费用为 3.32 万元/人。美国售 价,参考 K 药在美国的年费用为 1.75 万美元,折合人民币 11.38 万元; 预计特瑞普利单抗在美国销售存在一定的折价,假设年费用为 6.83 万 元。根据癌种分别考虑发病率、死亡率以及渗透率,假设各癌种下应 用特瑞普利单抗治疗的人数。此外,公司与 coherus 合作获得 1.5 亿 美元首付款。我们预计,2021/22/23 年特瑞普利单抗(不含 Coherus 首付款与里程碑款的)销售收入分别为 6/11/19 亿元。
埃特司韦单抗:公司与礼来合作,中和抗体联合疗法自 2021 年 2 月获 EUA 以来,已经提供超过 100 万剂埃特司韦单抗。2021 年新冠中和 抗体收入主要来自于礼来的“鸡尾酒”疗法的销售分成以及礼来剩余 的里程碑款项,假设剩余里程碑款项为 2 亿美元,折合人民币 12.8 亿 元。考虑到中和抗体价格较高,假设埃特司韦单抗费用为 1050 美元/剂,折合人民币 6720 元。随着新冠药物的陆续获批以及疫苗接种率的 提高,尤其 Omicron 变种对于中和抗体的较强逃逸,我们预计,未来 新冠中和抗体的采购量会逐渐下降, 2021/22/23 年新冠中和抗体收入 分别为 11.70/1.80/0.72 亿元。
新冠口服小分子药物 VV116 和 VV993:公司与旺山旺水公司合作,共 同承担在中亚五国、俄罗斯、北非、中东四个地区之外区域的开发和 商业化工作。目前针对 Rdrp 酶的氘代口服小分子 VV116 已经获得乌 兹别克斯坦 EUA,假设于 2022 年 Q3 在中国获批销售;VV993 为靶 向 3clpro 的蛋白酶抑制剂,假设 2023 年在中国获批销售。参考辉瑞 Paxlovid 价格为 500 美元/疗程,假设 VV116 与 VV993 在中国与海外 的销售均价为 1000 元/疗程。我们预计,2022/23 年新冠口服小分子 药物销售收入为 36/38 亿元。
阿达木单抗: 考虑阿达木单抗竞争格局较为激烈,假设 2022 年药品上 市后渗透率为 0.5%,价格为 1200 元/剂。我们预计,2022/23 年阿达 木单抗收入分别为 0.57/0.86 亿元。
昂戈瑞西单抗 PCSK9:公司自主研发的重组人源化抗 PCSK9 单抗, 临床数据显示出明显的降脂效果,可使血清低密度脂蛋白胆固醇较基 线降低 55%-70%,目前处于临床三期阶段,预计 2023 年上市。考虑 患者基数、治疗率、渗透率因素,我们假设 2023 年有 2 万人接受昂戈 瑞西单抗治疗,年费用为 9800 元/人。我们预计,2023 年昂戈瑞西单 抗销售收入为 1.96 亿元。
PARP 抑制剂:公司与英派合作的 PARP 抑制剂,针对铂类药物敏感 性晚期卵巢癌患者的一线治疗临床已经进入三期,假设于 2023 年获批。 考虑卵巢癌发病率、死亡率、晚期患者占比、渗透率等因素,假设 2023 年有 7280 人接受 PARP 抑制剂治疗,单人用药费用 3 万元。我 们预计,2023 年 PARP 抑制剂销售金额为 2.73 亿。
综上所述,我们假定 2022 年 VV116 和 VV993 在中国获批和没有获批两种 情景,并审慎选取平均值作为未来的盈利预测,预计公司 2021/22/23 年销 售收入 40.1/31.5/45.9 亿元;考虑到公司 2021 年新冠中和抗体是礼来的销 售分成,同时也是与中科院合作项目,故扣除支付中科院合作费用的生产 成本,会导致 2021 年的公司总体毛利率低于常规产品销售年份的 80%左 右,我们预计,公司 2021/22/23 年的净利润为-7.39/-2.85/0.23 亿元。
水晶球APP
高手云集的股票社区
X




 公安备案号 51010802001128号
公安备案号 51010802001128号